我科学家揭示人B细胞受体复合物组装分子机制
本文转自:科技日报
科技日报采访人员 李丽云 通讯员 张立辉
8月18日 , 哈尔滨工业大学生命学院/生命科学中心黄志伟课题组在《科学》上发表题为《两种亚型的人类B细胞受体的冷冻电镜结构》的研究文章 , 揭示了BCR复合物亚基的组装、识别机制 , 以及发现不同亚型BCR尽管在膜内具有保守的组装模式 , 然而在胞外却具有不同的组装模式 。
人类适应性免疫细胞(T细胞和B细胞)在病原感染、癌症发生以及自体免疫疾病中起着关键作用 。T、B细胞分别通过T细胞受体(TCR)和B细胞受体(BCR)识别抗原信号 , 把信号跨膜传递至胞内 , 激活T、B细胞的免疫反应 。T、B细胞受体属于一类由多个蛋白组成的最复杂的细胞受体 , 对T、B细胞的发育、分化、功能起着至关重要的作用 。TCR和BCR复合物信号转导 , 免疫激活的结构基础与分子机制问题一直是免疫学领域的重要基础科学问题 。
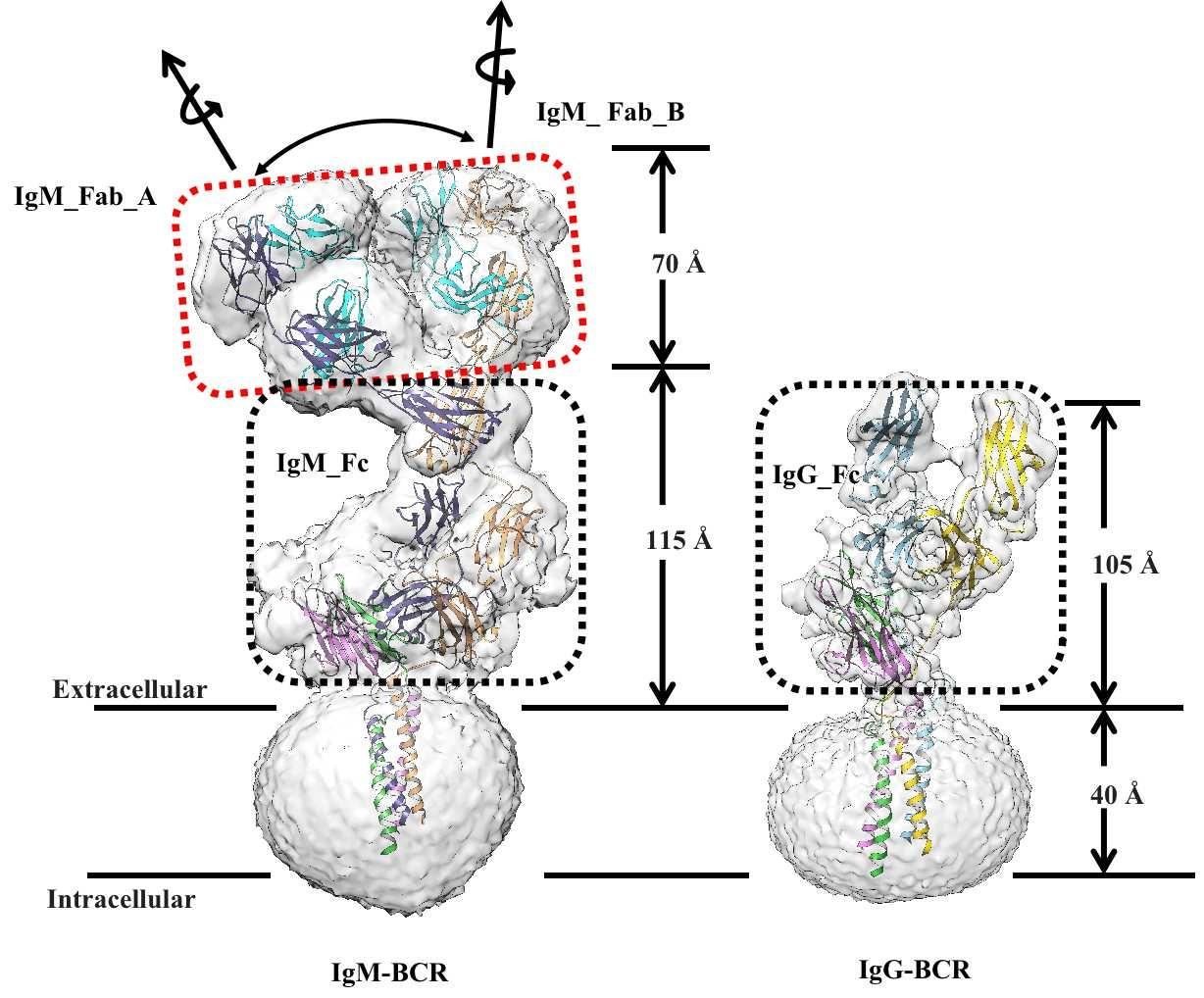
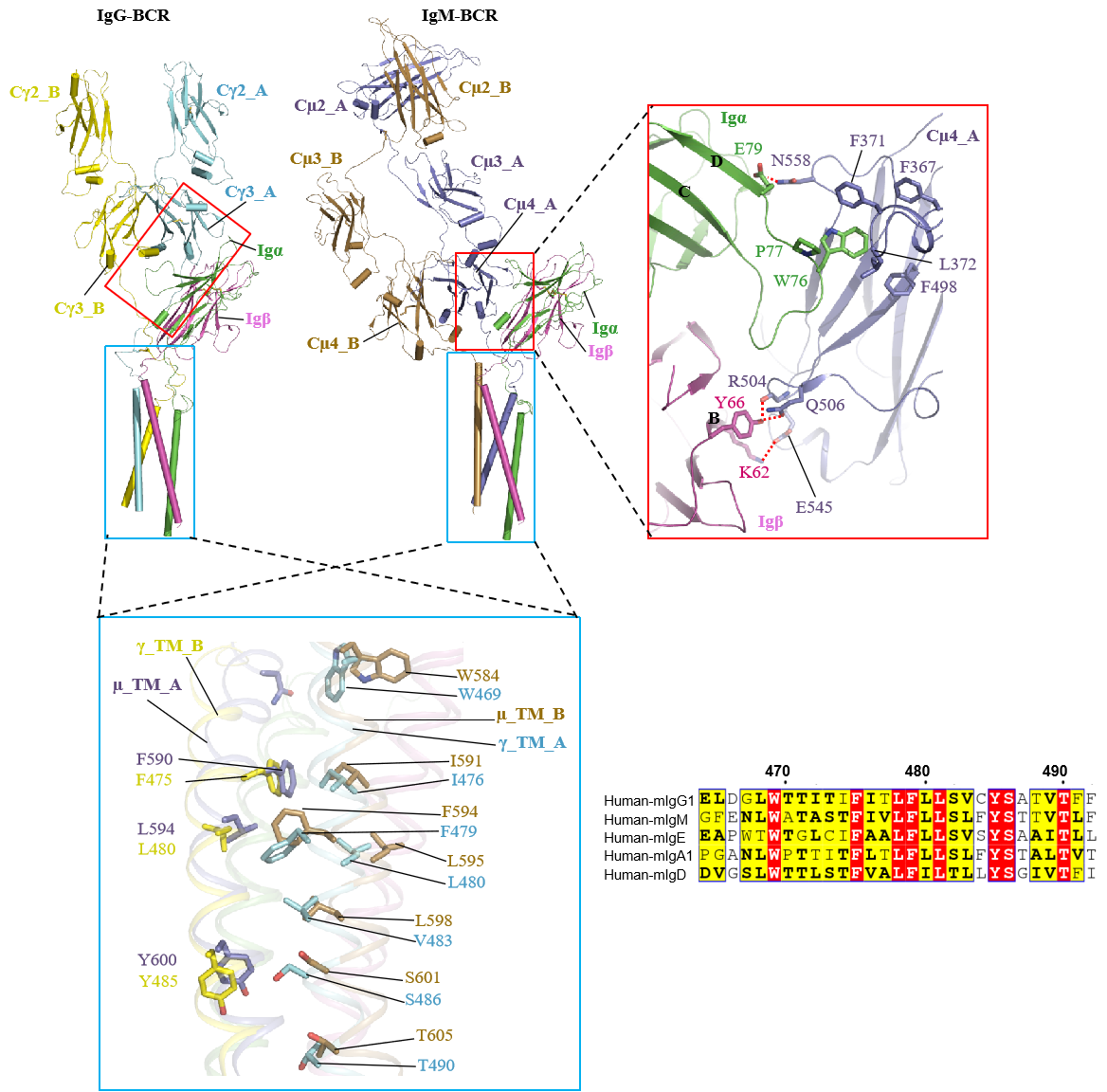
【我科学家揭示人B细胞受体复合物组装分子机制】人类B细胞受体有5种亚型 , 在该研究中 , 该课题组解析了人IgG和IgM两种亚型的BCR复合物结构 , BCR复合物结构包含了一个膜结合形式的免疫球蛋白(mIg)同源二聚体 , 用于识别抗原 , 一个膜结合形式的Igα/β(CD79α/CD79β)异二聚体 , 用于信号传递(化学计量比为1:1) 。其中 , mIg二聚体包含了Fab和Fc结构域、连接肽(CPs)和跨膜(TM)螺旋 , Igα/β结构由两个胞外Ig样结构域、CPs和TM螺旋组成 。IgG和IgM-BCR复合物的组装分别由胞外的IgG-Cγ3和IgM-Cμ4与Igα/β的Ig样结构域 , 以及连接肽、跨膜螺旋承担 。课题组通过两个亚型的结构比较发现 , mIgG和mIgM的跨膜螺旋区通过保守的疏水和极性作用与Igα/β 结合 。相比之下 , 在胞外区域 , IgG-Cγ3和IgM-Cμ4分别通过“首尾相连”(head-to-tail)以及“肩并肩”(side-by-side)的模式与Igα/β的Ig样结构域结合 , 其中 , Igα的CD loop 旋转了90度 , 分别与Cγ3和Cμ4结构域结合 。结构上观察的不同亚型组装模式是否和活性有关值得进一步研究 。
文章图片
文章图片
人IgG-和IgM-BCR复合物结构 。受访者供图
文章图片
文章图片
人IgG-和IgM-BCR复合物结构比较 。受访者供图
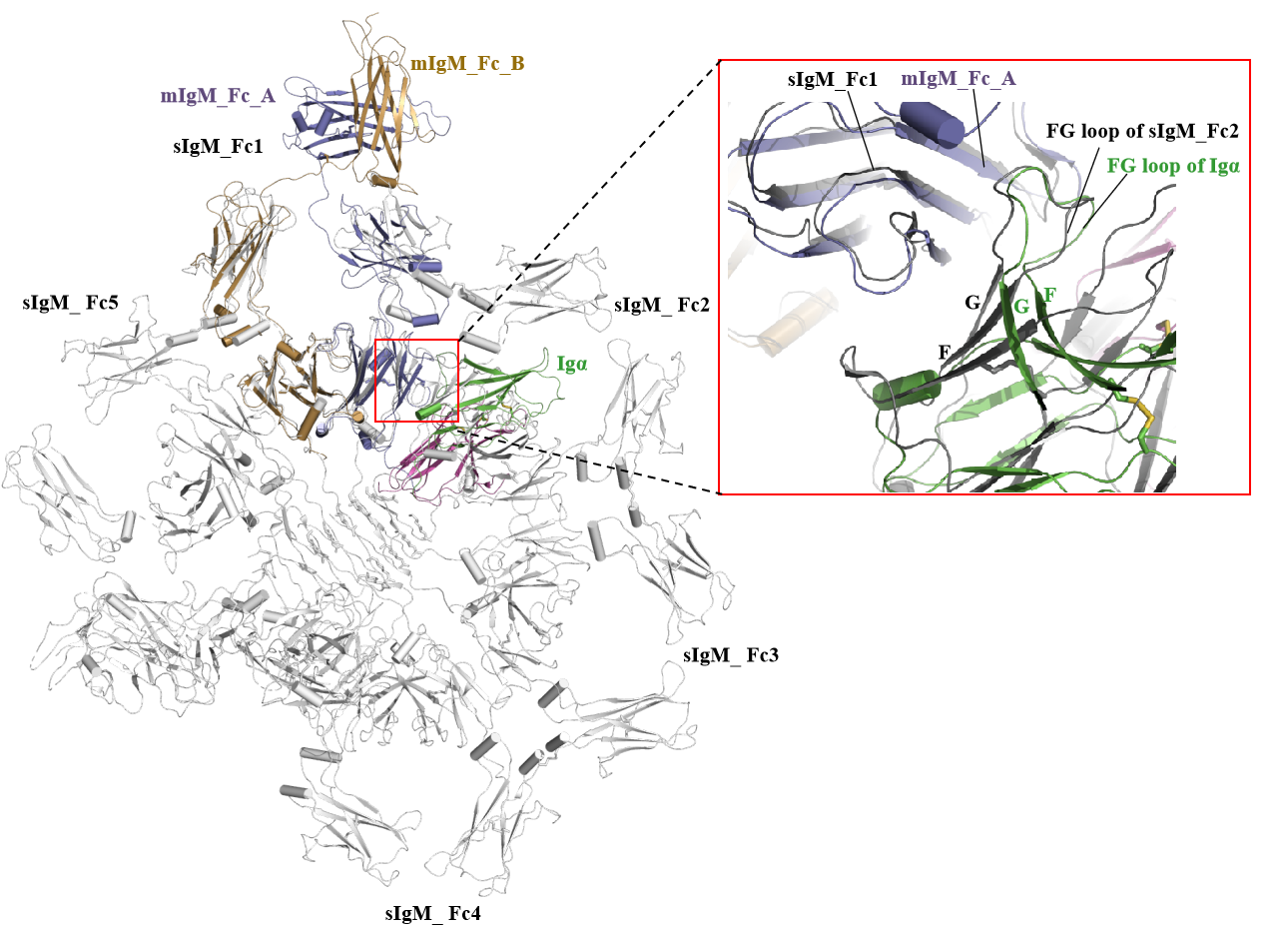
分泌型sIgM通常形成五聚体 , 但在膜结合的静息态BCR上只观察到IgM的单体状态 。结构分析显示Igα的Ig样结构域和膜结合的IgM-Cμ4完全重合 , 从而解释了膜结合的静息态IgM-BCR为什么处于单体状态 。BCR的激活通常伴随着BCR多聚体的形成 , 静息状态下 , 由于Igα/β的Ig样结构域与Cμ4或Cγ3结合 , 在空间上阻断了mIg寡聚化 , 而当抗原结合后可能会对Fab结构域施加机械力 , 以触发mIg_Fc的结构变化 , 从而释放被Igα/β占据的Cγ3或Cμ4的寡聚体界面 , 导致BCR分子形成寡聚体启动下游信号转导 , 其潜在机制还有待进一步研究 。电子密度分析分别在IgG和IgM-BCR上清晰地鉴定出6个和14个糖基化位点 。
文章图片
文章图片
分泌型sIgM和膜结合型mIgM-BCR复合物结构比较 。受访者供图
上述数据不仅解析了长久以来关于BCR结构与组装机制之谜 , 且对认识BCR启动免疫反应的分子机制 , 以及开发靶向BCR的免疫疗法用于治疗相关疾病提供了关键结构基础 。
- 真我的跨屏互联是易用的
- 饿了么免单一分钟8.19答案(饿了么免单8.19时间答案揭晓)
- 科学家找到火星制氧新方法
- 我国学者实现误差容忍高安全量子密钥分发
- 目标千亿级!华中首个脑科学产业基地揭牌
- 我们可能活在虚拟世界之中!
- 我国科学家向高压材料实际应用迈出关键一步
- 我国科学家研究解析苹果转座子插入调控等位基因特异性表达
- 科学家开发“微创”提取技术 让活细胞测序成为可能
- 促进我国电信业向更高质量发展
