研究揭示CpG岛结合蛋白BEND3调控分化过程中二价基因转录的功能
本文转自:中科院之声
2月10日 , 中国科学院生物物理研究所朱冰课题组与许瑞明课题组合作 , 在《科学》(Science)上 , 在线发表了题为Highly enriched BEND3 prevents the premature activation of bivalent genes during differentiation的研究论文 , 报道了CpG岛结合蛋白BEND3在二价基因上的高度富集 , 可以防止这些基因在分化过程中过早激活 。
CpG岛是脊椎动物基因组上的重要调控序列 , 富含非甲基化的CpG二核苷酸 , 常出现在活跃的管家基因(housekeeping genes)以及发育相关的二价基因(bivalent genes)的启动子区域 。2021年 , 瑞士弗里德里希·米歇尔生物医学研究所Dirk Schübeler课题组发现 , 序列特异性转录因子BANP能够结合并激活一部分含有CpG岛启动子的必需基因的表达 。而同样含有CpG岛启动子的二价基因 , 是否也会受到序列特异性结合蛋白的调控尚不清楚 。目前 , 关于CpG岛结合蛋白的研究有限 , 而关于CpG岛基因的表达调控尚待研究 。2016年 , 朱冰课题组鉴定到BEND3在体外倾向于结合含有非甲基化修饰的DNA(Molecular Cell) , 但关于该蛋白在体内的生理功能知之甚少 。
本研究中 , 科研人员发现BEND3能够特异性结合在基因组中含有CpG岛的活跃基因和二价基因的启动子区域 , 并找到了BEND3特异性结合的DNA基序 。通过与许瑞明组合作 , 研究解析了最关键的第四个BEN结构域结合DNA基序的共结晶结构 , 为BEND3序列特异性和DNA甲基化敏感结合特性提供了结构依据 。利用小鼠模型 , 研究发现Bend3敲除的小鼠胚胎会在原肠胚形成阶段死亡 。体内畸胎瘤形成实验和体外分化实验证明了Bend3敲除的小鼠胚胎干细胞虽然能够保持自我更新 , 但丧失了分化的能力 。为了找到发育和分化缺陷的分子机制 , 研究利用体外类胚体分化(EB分化)实验 , 结合RNA-seq技术 , 发现数百个被BEND3高度占据的二价基因在分化早期被异常激活 。结合各种全基因组学分析研究发现 , Bend3敲除导致一部分富含BEND3的二价基因启动子上SUZ12和H3K27me3水平的下降 , 致使这些失去PRC2和H3K27me3保护的二价基因在分化过程中在不恰当的时间被错误地提前激活 , 最终导致发育和分化的失败 。
在胚胎干细胞中 , 二价启动子(bivalent promoter) , 即同时存在激活性的H3K4me3和抑制性的H3K27me3组蛋白标记 , 通常被认为将发育相关基因维持在“蓄势待发”状态 , 以备在分化时快速激活 。然而 , 在小鼠胚胎干细胞中敲除MLL2以擦除H3K4me3修饰后 , 这些发育基因的快速激活未受到影响 。该研究证明了二价启动子上的H3K27me3修饰的重要性 , H3K27me3在分化前期起到“手刹”作用 , 帮助这些基因维持在“戒急缓发”状态 , 防止组织特异性基因的过早激活 , 保障胚胎发育过程中基因时空特异性地表达 。
【研究揭示CpG岛结合蛋白BEND3调控分化过程中二价基因转录的功能】研究工作得到科技部、国家自然科学基金委和中科院的支持 。
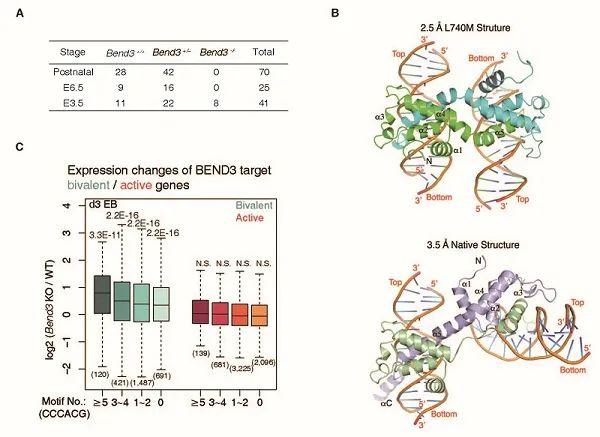
文章图片
文章图片
BEND3在小鼠胚胎发育以及胚胎干细胞分化过程中发挥重要功能
来源:中国科学院生物物理研究所
- 人工湿地-微生物燃料电池原位监测技术研究获进展
- 关于冻干玫瑰花的应用冻干工艺研究
- 中国矿业大学靖洪文教授:巷道锚杆锚固力学特性现场试验研究
- 研究揭示微重力环境提升三维培养神经干细胞修复脊髓损伤效果
- 谷爱凌起跳前的这个习惯,与登上《科学》的这项研究有关
- 中科院脑智卓越中心成果揭示“时空”记忆的奥秘
- 惠普威胁研究小组发现windows11假冒网站
- 阿卡迈发布最新研究报告,分析网络盗版问题持续盛行
- 地球内核超离子态物质研究获进展丨《自然》
- 创新“研究院经济” 铺就科技成果产业化“最后一公里”
